Закон Менделеева
Мы видели, что химические элементы делятся на металлы и металлоиды. Резкого разграничения в данном случае не имеется. Так, мышьяк и сурьма в чистом виде имеют свойства металлов, в соединениях - металлоидов. Йод и бром, будучи характерными металлоидами в чистом виде, способны в некоторых соединениях проявлять свойства металлов; хром и марганец в одних соединениях, как и в чистом виде, - резко выраженные металлы, в других - металлоиды.
Заметно также деление элементов на группы по сходству их свойств.
Менделеев, исходя из предположения, что свойства элементов находятся в зависимости от их атомного веса, классифицировал все известные в его время простые вещества, расположив их в виде особой таблицы. В современном, исправленном и дополненном, виде она приведена на следующей странице. Из нее видно, что свойства элементов находятся в периодической зависимости от их атомных весов. По мере количественного возрастания атомного веса изменяется качество элементов.
"Ряды в пределах которых совершается последовательно изменение свойств элементов, Менделеев назвал периодами. В двух периодах - от щелочного металла лития до галлоида фтора и инертного газа аргона - находится по 8 элементов. Это малые периоды. В следующих двух - больших периодах, третьем и четвертом между щелочным металлом и инертным газом, расположено по 18 элементов, в третьем большом периоде - 32 элемента и в последнем периоде, незавершенном, - 6 элементов.
"Большие периоды отличаются от малых не только тем, что в них большее число элементов, но и тем, что в них большинство элементов - металлы, и только в конце появляются металлоиды.
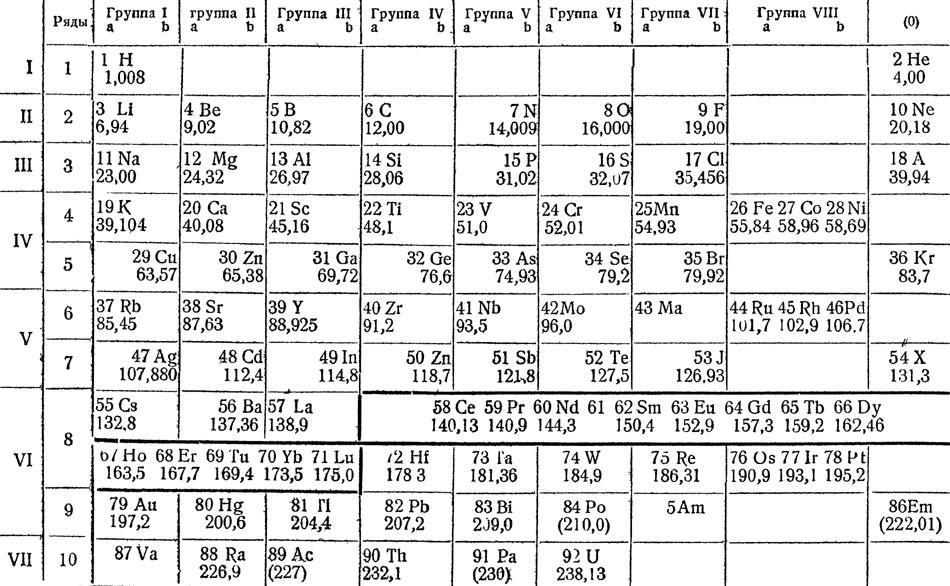
Периодическая система элементов по Д. И. Менделееву
"Большие периоды так же, как и малые, начинаются энергичными металлами, сходными с литием и натрием, но затем уменьшение металлических свойств и нарастание металлоидных идет медленно, и только в самом конце появляются металлоиды. Однако, в больших периодах есть одно свойство, по которому каждый большой период может быть разбит на две части, соответствующие малым периодам. Это валентность высших солеобразующих окислов.
"Если мы проследим изменение валентности элементов больших периодов по кислороду, то найдем, что сначала эта валентность повышается от единицы до семи, после чего идут три весьма сходных между собою элемента с одинаковой валентностью - восемь, а затем валентность падает до единицы и далее снова возрастает до семи, после чего падает до нуля.
"Таким образом, оказывается возможным поместить элементы больших периодов под имеющими соответственную валентность элементами малых периодов, при чем получаются столбцы элементов с одинаковой валентностью.
"В таблице имеется 10 рядов, причем в первом ряду стоят только два самых легких элемента - водород и гелий.
"Перед каждым символом элемента поставлена цифра,- это нумерация элементов по порядку, в каком они следуют один за другим, - порядковые номера. Под названиями элементов помещены атомные веса.
"Элементы в таблице образуют 9 столбцов или групп элементов с одинаковой валентностью. Последняя группа - группа инертных газов, не вступающих в соединения, обладающих "нулевой валентностью", обозначена нулем - нулевая группа".
"Внизу таблицы даны типы соответствующих элементам групп высших солеобразующих окислов, при чем вместо знака элемента поставлена буква R, не являющаяся символом какого-либо определенного элемента. Ниже даны типы высших газообразных водородных соединений, известных только для IV-VII групп. Как видно из этих типовых формул, валентность элементов по водороду, с увеличением атомного веса, в горизонтальных рядах уменьшается. Например, хлор, семивалентный по кислороду, образует с водородом соединение типа RH, а именно хлористый водород. Здесь хлор одновалентен. Следует отметить, что сумма валентностей по кислороду и водороду оказывается постоянной и равна 8".
"Когда Менделеев вырабатывал таблицу элементов, руководствуясь периодическим законом, ему было известно только 64 элемента, тогда как теперь мы знаем 92 элемента. Поэтому в первой таблице Менделеева оказалось много пустых мест, и между прочим там, где теперь стоят элементы скандий Sc (4-й ряд III гр.), галлий Ga (5-й ряд III гр.) и германий Ge (5-й ряд IV гр.).
"В то время соответствующие элементы еще не были известны, а другие элементы, близкие по атомному весу, не могли занять указанных мест, так как не подходили к ним по своим свойствам и по типу соединений. Опираясь на периодический закон, Д. И. Менделеев в 1871 г. высказал убеждение, что должны существовать элементы, места которых указываются этими промежутками.
"На основании точного знания свойств элементов, расположенных рядом с этими пробелами в вертикальном и горизонтальном направлениях, Д. И. Менделеев уже тогда определил возможные величины атомных весов этих элементов, а также указал, какими свойствами должны обладать сами эти элементы в виде простых веществ, какие соединения они могли бы образовать и какими свойствами эти соединения должны отличаться. Предсказания Д. И. Менделеева с полной точностью подтвердились. Недостающие элементы были открыты еще при жизни Менделеева".
Предсказание Менделеева о возможности открытия новых элементов с указанием их свойств часто сравнивают с другим научным "дальновидением" - с предсказанием астронома Леверье о существовании неизвестной планеты в нашей Солнечной системе. Действительно, такая планета, названная Нептуном, была открыта. Часто говорят, что Леверье открыл Нептуна "на кончике своего пера". С неменьшим правом можно сказать и о Менделееве, что он своим пером открыл все до него не бывшие известными элементы.