Рассчитайте массу гидроксида бария, которая потребуется для нейтрализации 1250 г соляной кислоты с массовой долей HCl 14,6%
РЕШЕНИЕ
Решение этой задачи на фото
Находим чистый HCIв 1250 г
1250*14,6:100=182,5 г
182,5 х г
2HCI + Ba(OH)2=BaCI2+2H2O
n=2 моль n=1 моль
М=36,5 г/моль М=171 г/моль
m=73 г m=171 г
182,5:73= х:171
х=(182,5*171)/73=427,5 г
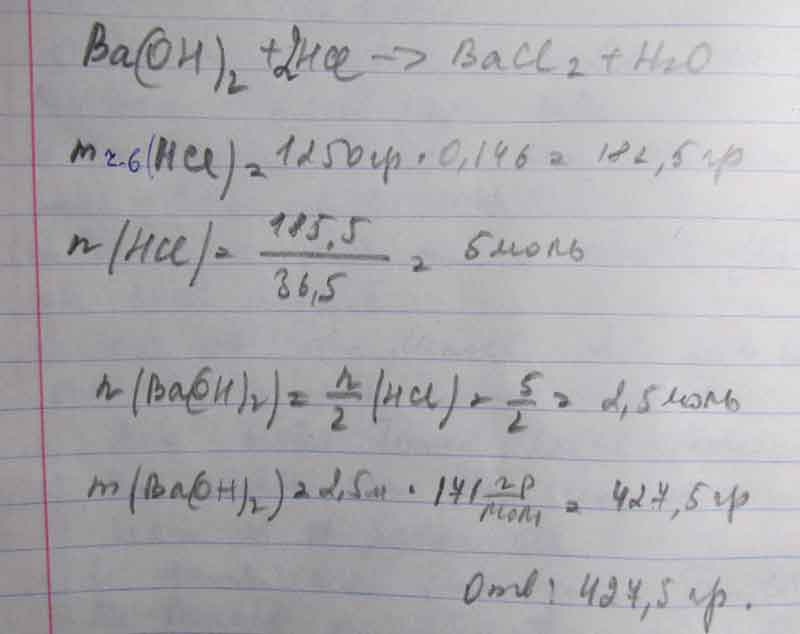
ПОХОЖИЕ ЗАДАНИЯ:
Тема: Сколько граммов потребуется
Тема: Определите долю
Тема: Какая масса соли образуется при взаимодействии
Тема: Какой объем кислоты
Тема: Определите долю